在国家自然科学基金项目(批准号:21675001, 21725505, 21976004, 21936001)等资助下,我校王广凤教授团队与中国科学技术大学梁高林教授合作,利用弗林蛋白酶(Furin)水解及点击缩合反应,建立了金纳米(AuNP)胞内原位自组装方法,在增强活体肿瘤光声成像和光热治疗(PTT)效果方面取得了重要进展。研究成果以:“弗林酶介导胞内金纳米聚集用于肿瘤光热治疗(Furin-Instructed Intracellular Gold Nanoparticle Aggregation for Tumor Photothermal Therapy)”为题,于2020年9月16日在《先进功能材料》 (Advanced Functional Materials)上发表。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202001566。
PTT由于其非侵入性、高时空选择性、疗效显著等优点已成为肿瘤治疗领域的研究热点。理想的光热制剂(PTA)对肿瘤的有效PTT至关重要。金纳米以其良好的生物相容性、化学惰性、表面等离子体共振效应可调等特点,成为目前应用最广泛的无机PTA之一。然而,小粒径的金纳米颗粒用于光热治疗仍存在肿瘤处富集量低、滞留时间短、特异性差、光热效率低等不足,极大地限制了他们在生物医学领域的应用。因此,实现金纳米肿瘤靶向聚集是提高其光热治疗效率的关键和挑战之一。
在此,课题组利用相关肿瘤上调的反式高尔基蛋白转化酶Furin特异性识别剪切以及具有生物相容性的2-氰基苯并噻唑-半胱氨酸(CBT-Cys)的缩合反应,开发了一种Furin介导的细胞内AuNP自组装策略,设计合成 Furin响应型AuNP探针(AuNP@1),在Furin高表达的肿瘤细胞内实现金纳米可控靶向聚集(图1),显著提升其光热行为,用于体内外肿瘤的高效光热治疗(图2)。
该工作实现了肿瘤细胞内金纳米的“智能”自组装,解决了传统金纳米光热治疗的局限性,也为“智能型”光声成像探针的开发提供新的选择,在临床光热治疗具有良好的应用前景。
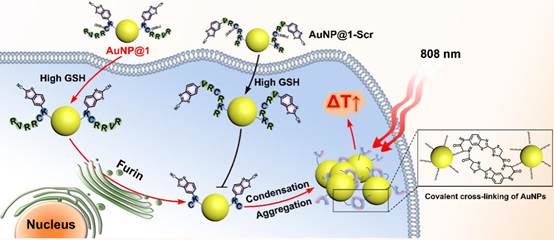
图1. Furin介导金纳米聚集及其光热治疗示意图
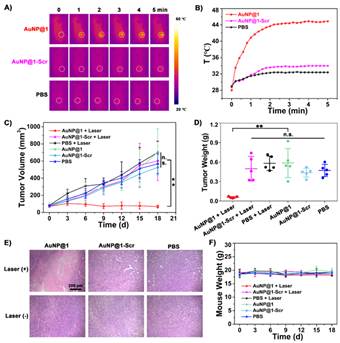
图2. Furin介导的金纳米原位自组装评估肿瘤光热治疗效果
















